Er is dringend nood aan betere medicatie tegen schimmelinfecties. In die zoektocht worden steeds vaker rupsen ingezet als proefdier. Om dit insectenmodel betrouwbaarder te maken, gaven wij de rupsen een stralende upgrade.
Rupsen, schimmelinfecties en lichtgevend. Het lijkt een uitdaging om die drie woorden in één zin te gebruiken, maar voor mij is het een alledaagse combinatie. Ik doe onderzoek naar schimmelinfecties in de longen, onder andere naar nieuwe behandelingen tegen ziekmakende schimmels. Daarbij gebruiken we proefdieren. We infecteren het proefdier met de schimmel om de infectie in mensen zo goed mogelijk na te bootsen. Op dat moment spreken we van een ‘proefdiermodel’, waarin we nieuwe medicatie kunnen testen.
De laatste jaren zet de wetenschap steeds meer in op ethische alternatieven voor muizen als proefdiermodel om nieuwe medicatie te testen; opgekweekte organen (‘organoïden’), computersimulaties, lab-on-a-chip… en dus ook rupsen. De rups is een veelbelovend proefdiermodel dat nog in de kinderschoenen staat. Om nog beter het effect van antischimmelmedicatie te detecteren, gaven we dit rupsenmodel een biotechnologische upgrade en maakten het lichtgevend, of bioluminescent.
Schimmelinfecties, een stille crisis
Ziekmakende schimmels zijn overal; op die vergeten appelsien in je fruitmand, in je composthoop en zelfs in de frisse boslucht op je herfstwandeling. Dagelijks ademen we honderden sporen in, en toch worden de meeste mensen er niet ziek van. Als je immuunsysteem werkt zoals het hoort, zal je lichaam de sporen immers uitschakelen. Dat ligt anders bij mensen met een verzwakt immuunsysteem, zij kunnen levensbedreigende schimmelinfecties ontwikkelen in de longen. Wereldwijd kampen steeds meer mensen met een verzwakt immuunsysteem. Dit heeft verschillende oorzaken; chronische (long)ziekten, immuun-onderdrukkende therapieën na een orgaantransplantatie of als onderdeel van een kankerbehandeling, HIV/AIDS ...
Hoewel er medicatie bestaat, overlijden toch nog veel mensen aan een schimmelinfectie. Dit komt onder andere door ernstige bijwerkingen en groeiende resistentie van schimmels tegen triazoles, de meest gebruikte klasse van antischimmelmedicatie. Er is dus dringend nood aan meer en betere behandelingen, en die zoektocht begint in het lab. Onderzoekers testen nieuwe medicatie eerst in celculturen (in vitro). Hierbij worden de schimmel en de medicatie samengevoegd in een vloeistof of op een voedingsbodem. Als de medicatie die test doorstaat, kan het in levende dieren getest worden (in vivo). Je denkt daarbij misschien spontaan aan witte labmuizen, maar wetenschappers zijn terughoudend om zo snel naar een “hoger” organisme te grijpen. Het is veel ethischer om met een tussenmodel te werken, en daar komen de rupsen in het vizier.

De grote wasmot, redder in nood?
De rupsen die we als proefdier gebruiken zijn die van de grote wasmot, ofwel Galleria mellonella, en leven in de natuur vaak in bijenkorven. Wetenschappers ontdekten dat deze rupsen niet alleen ziek worden van dezelfde schimmels als wij, maar ook een vergelijkbaar aangeboren immuunsysteem hebben -al moeten ze het wel zonder aangeleerd immuunsysteem doen. Maar vooral: in tegenstelling tot gewervelde dieren hebben rupsen geen pijnreceptoren. Daardoor kunnen ze geen pijn voelen van een infectie; ideaal dus om nieuwe medicatie voor het eerst op uit te testen.
Ook kunnen we de rupsen gemakkelijk zelf kweken in ons lab. Eens ze volgroeid zijn, infecteren we ze met een ziekmakende schimmel die zich steeds verder vermenigvuldigt in de rups. Verschillende groepen geïnfecteerde rupsen krijgen verschillende potentiële antischimmelmedicaties toegediend, die we op die manier kunnen testen tegen de infectie.
'Rupsen hebben geen pijnreceptoren, en kunnen dus geen pijn voelen van infecties; ideaal om nieuwe medicatie voor het eerst op te testen'
Klinkt goed, toch? Waarom wordt dit proefdier dan niet standaard gebruikt in het lab, zoals muizen of ratten? Galleria mellonella rupsen zijn een relatief recent proefdier, en de wetenschappelijke methodes om hen te onderzoeken in het lab zijn nog beperkt. Meestal kijken onderzoekers of de rupsen na infectie en behandeling nog leven, hoeveel ze nog bewegen, en of ze een gezonde kleur hebben. Daar wordt dan een cijfer op 10 op geplakt. Dit is een heel subjectieve en onnauwkeurige maatstaf voor de algemene gezondheid van de rups. Deze zogenaamde ‘gezondheidsscore’ verschilt dan ook sterk tussen verschillende labs en is niet altijd te vertrouwen. De rupsen kunnen immers ook ziek worden van stress of besmetting met andere pathogenen, wat tot foute conclusies kan leiden over de geteste medicatie.
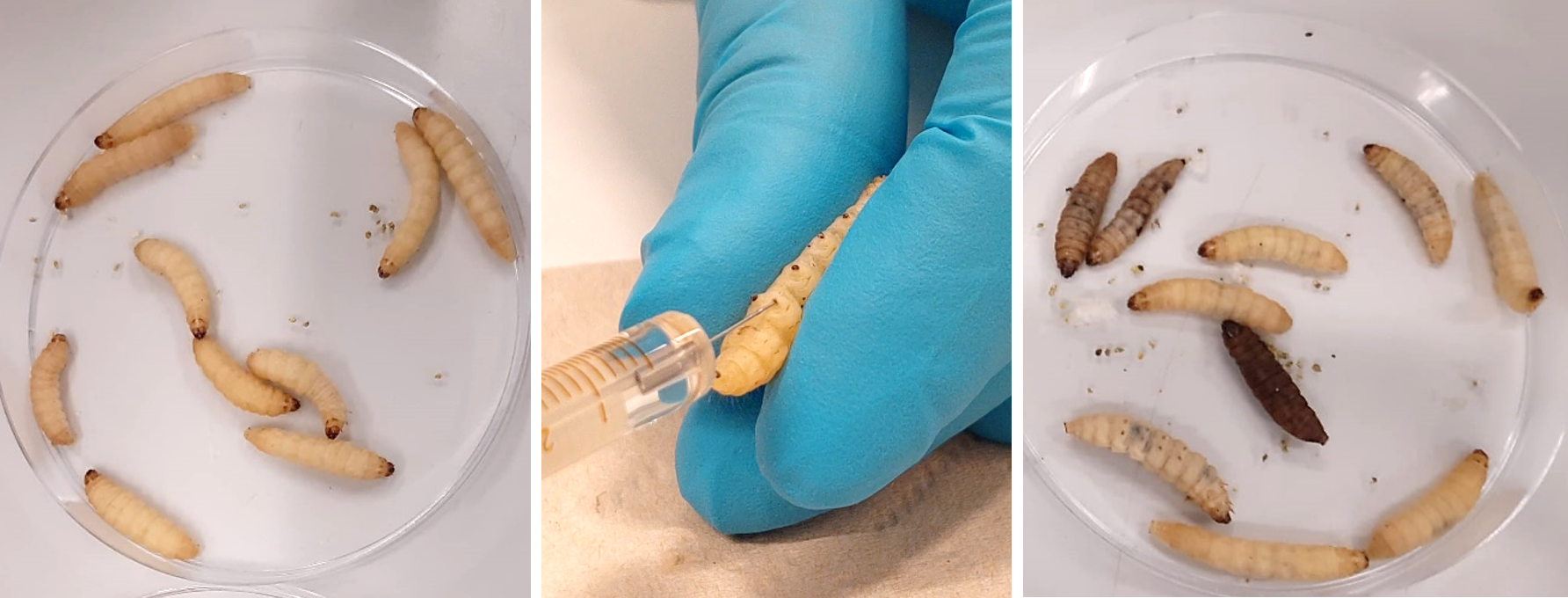
We hebben een test nodig waarmee we exact kunnen bepalen hoeveel schimmels er in elke rups zitten. Zo kunnen we in cijfers gieten hoe goed de medicatie werkt, onafhankelijk van de invloed van omgevingsfactoren op hun algemene gezondheid. De makkelijkste manier om de schimmels te tellen, is de rups te doden en het aantal aanwezige schimmelkolonies in hun lichaam te onderzoeken op een voedingsbodem. Maar zo kunnen we de rupsen niet over meerdere dagen opvolgen en verlies je belangrijke info. We moeten de hoeveelheid schimmel in de rupsen dus kunnen onderzoeken terwijl ze leven. Met die doelen gingen we aan de slag in het lab: we ontwierpen een test op basis van lichtgevende schimmels die we dwars door de huid van de rups zien schijnen.
Lichtgevende schimmels
Mijn collega’s ontwikkelden enkele jaren geleden lichtgevende of bioluminescente schimmels met gentechnologie. Het systeem om schimmels lichtgevend te maken, is trouwens afgekeken van vuurvliegjes. Ze voegden een stukje DNA van het vuurvliegje toe aan het DNA van de schimmel, waardoor de schimmels een extra gen krijgen waarmee ze een extra eiwit kunnen produceren. Dat eiwit heeft de functie van een enzyme, dat licht kan produceren: luciferase. Wanneer we bijgevolg de genetisch gemodificeerde schimmel injecteren in onze rupsen, produceert de schimmel luciferase ín het lichaam van de rups. Luciferase op zich geeft geen licht. Wanneer het echter in contact komt met luciferine, een ander stofje, ontstaat er een chemische reactie waarbij licht geproduceerd wordt. Als wij dus onze geïnfecteerde rupsen injecteren met luciferine, komen luciferase en luciferine samen in het lichaam van de rups, en zal er een lichtsignaal geproduceerd worden dat we kunnen meten. De sterkte van dat lichtsignaal is representatief voor de hoeveelheid aanwezige schimmel in de rups. Een sterk lichtsignaal betekent dat er nog veel schimmels aanwezig zijn, en dat de geteste medicatie bijgevolg niet gewerkt heeft. Omgekeerd, weten we dat de medicatie effectief was als we weinig of geen licht meten en de schimmels dus bestreden zijn. De rupsen ondervinden van de bioluminescentie geen enkele last. Door hen dag na dag onder een gevoelige camera te leggen, kunnen we het gemeten licht in cijfers gieten. Zo kunnen we heel precieze resultaten bekomen over hoe goed of slecht de testmedicatie werkt tegen schimmelinfecties, die veel betrouwbaarder zijn dan die gezondheidsscores waar we het eerder over hadden.

Wie intussen overweegt om deze lichtgevende rupsen te gebruiken voor een spectaculaire Halloween-act, moet ik teleurstellen. De lichtsignalen die uit de rups – of eigenlijk uit de schimmels ín de rups – komen, zijn namelijk niet met het blote oog waar te nemen. Je hebt er een gespecialiseerde camera voor nodig met hoge gevoeligheid. Door de sterkte van de gemeten lichtsignalen echter om te zetten in een kleurenschaal, kunnen we ook visueel volgen hoeveel schimmel er precies aanwezig is in de rups en waar.

Van rups naar mens?!
En wat als we een nieuw medicijn vinden dat werkt? Niemand wil natuurlijk medicatie nemen die enkel in rupsen getest is; het blijft uiteindelijk een insect dat evolutionair ver van de mens staat. De medicijnen zullen daarom nog steeds in muizen getest worden, vooraleer ze nog veel meer klinische testfasen ondergaan in gezonde vrijwilligers en in patiënten. Door de tussentijdse testen in rupsen kunnen we echter al veel medicijnen schrappen die niet werken, of een voorlopige dosis bepalen van een medicijn dat wél werkt. Daardoor zijn er minder muizen nodig in de volgende stap en bijgevolg minder dierenleed. En het is ook nog eens financieel voordelig waardoor het onderzoek minder kost.
Maar die muizen, moeten die dan wel gedood worden om de hoeveelheid schimmel in hun lichaam te meten? Nee hoor, we gebruiken dezelfde lichtgevende schimmel gewoon in de muizen en maken zo… lichtgevende muizen!
Gebaseerd op https://pubmed.ncbi.nlm.nih.gov/37466453/



