De genbewerkingstechniek crispr ontketende een ware revolutie in de wetenschap. Hoe werkt die ‘genetische schaar’ precies? Dat mocht Eos-redacteur Kim Verhaeghe zelf ervaren tijdens een spoedcursus crispr in het lab van Joleen Masschelein aan de KU Leuven en het VIB.
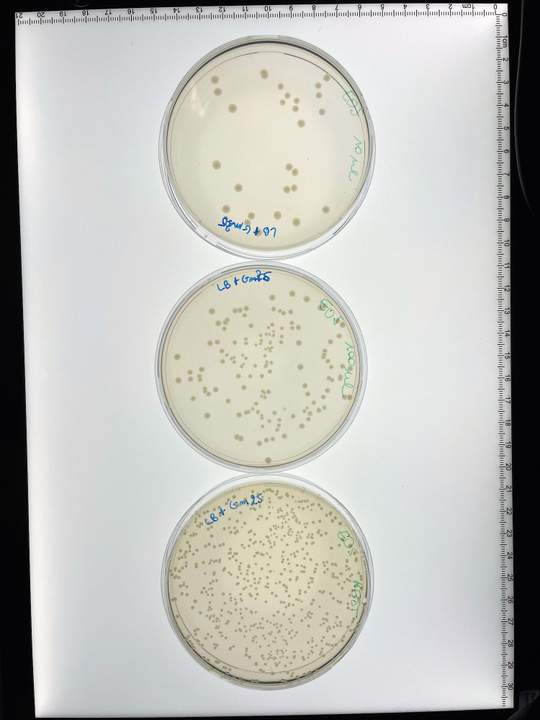
‘Proficiat! Je eerste genetisch gemodificeerd organisme!’ Terwijl ik de complimenten van microbiologen Sofie en Hanne in ontvangst neem, staar ik met een soort ouderlijke trots naar een klein plastic buisje dat ik tussen mijn duim en wijsvinger vasthoud. In het buisje zit een doorzichtige vloeistof. Eigenlijk is er helemaal niets te zien, maar ik besef dat ik kijk naar een bacterie waarin ik eigenhandig een nieuw stukje DNA heb geknutseld.
Ik haal met een pipet voorzichtig een paar druppels bacterie uit het buisje, en plaats ze op een petrischaaltje. In dat schaaltje had ik daarnet al agar gedaan, een stroperige gelatine waar micro-organismen verzot op zijn, gemengd met een antibioticum waartegen alleen de door mij gemodificeerde bacterie resistent is. Zo weten we zeker dat alleen zij blijft leven en groeien. Nu enkel nog wat uitstrijken, petrischaaltje sluiten en een nacht in de incubator plaatsen.
‘Morgen weten we hoe levensvatbaar je bacterie is’, zegt microbioloog Sofie Dekimpe. Zij en haar collega’s Hanne Vande Capelle en Hans Gerstmans van het Joleen Masschelein Lab for Biomolecular Discovery & Engineering van de KU Leuven en VIB hielpen mij de afgelopen dagen om mijn allereerste crispr-bacterie te maken. Ik heb geen opleiding in de microbiologie gehad, ik werkte hiervoor nog geen dag in een lab en ik hanteerde nog nooit een pipet – een echte leek dus.
Tien jaar geleden waren de technieken om slechts één verandering in DNA aan te brengen nog zeer tijdrovend, arbeidsintensief en duur. En toen kwam crispr
Het is woensdagmiddag, amper twee dagen nadat ik in een geleende witte jas het lab binnenstapte, en mijn eerste genetisch gemodificeerd organisme is klaar. Dat is waanzinnig. Tien jaar geleden waren de technieken nog zeer tijdrovend en arbeidsintensief. Het kon enkele maanden tot een half jaar duren om slechts één verandering in DNA aan te brengen, het was ontzettend duur, en de modificatie was een pak minder precies. En toen kwam crispr. Tien jaar en een Nobelprijs voor de bedenkers Emmanuelle Charpentier en Jennifer Doudna later is het voor wetenschappers een routineklus geworden om snel, precies en goedkoop wijzigingen aan te brengen in het DNA van om het even welk organisme. Er zijn zelfs doe-het-zelfkits te koop via het internet waarmee je thuis aan de keukentafel gezellig DNA kunt crispr’en.
Genetische schaar
Sinds 2012 schrijf ik dan ook regelmatig over crispr, en als wetenschapsredacteur is het mijn opdracht om complexe zaken te vereenvoudigen. De populairste analogie is die van crispr als genetische schaar en plakband, maar misschien is de vergelijking met een chirurgische scalpel die geen littekens achterlaat beter, of die met een teksteditor om het boek van het leven (dat bestaat uit duizenden regels A’s, C’s, G’s en T’s) hier en daar te herschrijven. Die analogieën maken het makkelijker om het boeiende en spannende verhaal van crispr te vertellen, maar wetenschappers zitten uiteraard niet echt met een knipschaar en een rol plakband genen in elkaar te knutselen. Ik vroeg daarom al vaker aan genetici hoe dat crispr’en er in het echt uitziet. Microbioloog Joleen Masschelein was de laatste aan wie ik het vroeg, want zij antwoordde doodleuk: ‘Misschien moet je het hier eens komen leren?’ Een uitnodiging die ik niet negeer, en dus stapte ik maandagochtend haar lab aan de KU Leuven binnen. Masschelein en haar team gaan hier op zoek naar bacteriën die medicijnen voor ons kunnen produceren. Soms moet je die bacteriën daarvoor een beetje finetunen, en dat kan met crispr.
Biologische medicijnfabriekjes
‘Meer dan de helft van de geneesmiddelen die we tegenwoordig in het ziekenhuis gebruiken zijn afgeleid van bacteriële stoffen’, verduidelijkt Masschelein. ‘Bacteriën en schimmels produceren moleculen die de basis vormen voor middelen tegen ziekteverwekkers, maar die evengoed het cholesterolniveau in ons lichaam kunnen beïnvloeden, of zelfs kanker bestrijden. Die bacteriën hebben uiteraard hun eigen redenen om die stoffen te produceren, maar wij kunnen ze isoleren en gebruiken om medicijnen te maken. Chemici kunnen die interessante moleculen ook op een synthetische manier maken in het lab, maar dat is vaak een heel uitdagend, moeilijk en duur proces. Bacteriën zijn in staat om dezelfde moleculen veel efficiënter en sneller aan te maken.’
‘We zien wel vaak dat bacteriën de interessante stoffen die ze in hun natuurlijke omgeving produceren in het lab plots niet meer maken. In het lab groeien bacteriën op in zeer rijke omstandigheden, waardoor ze de nood niet meer voelen om hun wapens te produceren. We moeten ze dan wat meer onder druk zetten. Of we gaan eerst op zoek naar de genen die verantwoordelijk zijn voor de productie van een interessante stof. Dat kunnen we doen door genen uit te schakelen tot de bacterie de moleculen niet meer produceert. Zo achterhalen we welke genen noodzakelijk zijn. Die genen kunnen we vervolgens isoleren en inbouwen in een bacterie die het wel zeer goed doet in het lab. Meestal is dat Escherichia coli (of E. coli), de witte labmuis onder de bacteriën. We maken zo eigenlijk biologische medicijnfabriekjes, met dank aan de crispr-techniek.’

Microbiologen Hanne Vande Capelle en Sofie Dekimpe vertellen tijdens een introductieles dat crispr in de natuur al miljarden jaren bestaat.
Ik mag als gast in het lab het genoom van een E. coli-stam aanpassen zodat hij de antibiotica die doctoraatstudent Hanne Vande Capelle bestudeert beter kan produceren. Vande Capelle: ‘We schenken de bacterie de genetische handleiding van een bacterie die de gewenste stoffen wel van nature kan produceren.’
Zeg trouwens niet zomaar E. coli tegen een E. coli, want er bestaan duizenden varianten met elk hun eigen handige eigenschappen. ‘Deze E. coli-stam is zeer goed in het opnemen van nieuwe stukjes DNA. Dat is handig om te achterhalen of de nieuwe stukjes correct ingebouwd zijn. Als die onderzoeken positief zijn, dan kiezen we een andere E. coli-stam die vlotter veel van de stoffen die je wil oogsten produceert. We hebben hier een collectie E. coli-varianten in een diepvriezer op min tachtig graden Celsius zitten, maar je kan ze evengoed in alle maten en kleuren bestellen via het internet.’
Bacterieel afweergeschut
Voor ik de genetische schaar voor het eerst zelf mag hanteren, willen Hanne en Sofie me nog een introductieles crispr geven. ‘Crispr bestaat in de natuur al miljarden jaren. Het is een defensiemechanisme van bacteriën tegen virussen’, begint Dekimpe. ‘Virussen planten zich voort ‘op een ander’. Ze injecteren hun genetisch materiaal in een gastheer en gebruiken diens machinerie om zich te vermenigvuldigen. Een bepaalde klasse van virussen, de bacteriofagen of kortweg fagen, focussen zich op bacteriën. Ze kapen een bacterie en vermenigvuldigen zich tot de bacterie openbarst en de ‘kleine virusjes’ loslaat. Af en toe overleven bacteriën zo’n aanval en bereiden ze zich op een ingenieuze manier voor op een volgend offensief. De bacteriën bouwen een stukje faag-DNA in hun eigen DNA in. Zo hebben ze iets om in de toekomst nieuwe aanvallers meteen te herkennen. Die ‘genetische opsporingsberichten’ heten Clustered Regularly Interspaced Short Palindromic Repeats, crispr dus. Wanneer een bacterie een vijand aan de hand van zo’n stukje herkent, schiet het bacterieel afweergeschut in actie: Cas, een eiwit dat het DNA van de aanvaller genadeloos in stukken knipt. Pioniers Emmanuelle Charpentier en Jennifer Doudna hebben dit bacterieel defensiemechanisme naar hun hand gezet zodat het in DNA kan knippen, precies op de plek waar wij, onderzoekers, dat willen.’
Naast het Cas-eiwit is er nog een andere molecule cruciaal in het crispr-systeem: het gids-RNA. Dekimpe: ‘RNA is eenvoudig gezegd een afgeleide van DNA die gebruikt wordt tijdens het kopiëren van genen. In dit geval begeleidt een stukje gids-RNA het Cas-eiwit naar de exacte locatie waar het een gen in twee moet knippen. De volgorde van de nucleotiden (A, C, G, T) in het gids-RNA is uniek, waardoor het Cas-eiwit maar op één plek in het DNA kan knippen.’
‘Het meest bijzondere aan mijn crispr-vuurdoop? Hoewel ik stukjes DNA in mijn handen had, heb ik niets ooit echt gezien’
Na het knippen volgt het plakken. Je kan met crispr zowel één letter in de DNA-code veranderen als een heel nieuw gen inbrengen. Dit laatste heb ik gedaan in mijn crispr-spoedcursus. ‘We hangen aan beide uiteinden van het stukje dat we willen introduceren een reeks nucleotiden die precies past op de uiteinden waar het DNA is geknipt.’ Het lijkt wat op klittenband: het nieuwe stukje heeft een zachte velcroband op haar uiteinde, en het DNA van de bacterie een ruwe velcroband. Schud ze door elkaar en uiteindelijk zullen beide velcrohelften elkaar vinden en blijven kleven.
Om de crispr makkelijk te kunnen uitvoeren, moet ik het nodige gereedschap eerst in een plasmide inbouwen. Een plasmide is een cirkelvormige streng DNA waarmee bacteriën ‘in het wild’ genetische informatie uitwisselen, zelfs tussen verschillende soorten. In de eerste plasmide stop ik alles voor het knippen: het Cas-eiwit en het gids-RNA. In het tweede plasmide zit dan alles om het nieuwe stukje in het geknipte DNA te plakken. Vande Capelle: ‘Om de crispr te voltooien, moeten we beide plasmiden ‘aanbieden’ aan de E. coli-stam.’
Blind koken
Tot nu toe blijft het nog altijd heel theoretisch. Voor het knippen en plakken in het echt laten Sofie en Hanne me een rek zien waarop verschillende dozen staan. Het zijn kits die je stap voor stap begeleiden in het crispr’en – zeer gelijkaardig aan de populaire maaltijdboxen die je thuis laat leveren en waarin alle ingrediënten zitten om een bepaald gerecht te koken. Het is dan simpelweg een kwestie van het recept goed te volgen en straks smakelijk te eten.
Het grote verschil met de maaltijdboxen is dat ik hier moet koken met onzichtbare ingrediënten, zonder kleuren, geuren of smaken. Ik kijk de hele tijd naar een doorzichtige vloeistof, schijnbaar gewoon water dus, waaraan ik zoveel microgram van een andere doorzichtige vloeistof moet toevoegen, en dan nog eens zoveel microgram van nog een andere, jawel, doorzichtige, vloeistof. Sofie en Hanne vertellen me intussen dat dit transparante vloeistofje dient om het DNA van de bacterie te laten openscheuren, en dat transparante stofje om het DNA op een heel nauwkeurige plek te knippen, en nog andere stofjes om overtollige ingrediënten weg te wassen.
Het mengsel warmen we op tot 42 graden Celsius, volgens het recept net de juiste temperatuur om de bacterie zodanig te prikkelen dat zij het nieuwe stukje DNA opneemt. Dekimpe: ‘In de natuur nemen bacteriën ook continu nieuwe stukjes DNA uit hun omgeving op. Zo versterken ze zichzelf of ‘leren’ ze een nieuwe vaardigheid. We maken gebruik van dat principe, je moet gewoon de prikkel kennen waardoor ze instant de drang voelen om genen uit de omgeving op te nemen.’
Nadat ik alle stappen heb doorlopen – ik denk dat ik een drietal verschillende ‘maaltijdboxen’ heb gebruikt – is de aangepaste microbe klaar. Dan geef ik het beestje te eten. Dit keer niet nog eens een transparante vloeistof, maar agar, iets wat lijkt op een stroperige ice tea en in een petrischaaltje stolt tot gelatine. De bacteriën zullen hierin zodanig groeien dat ze tegen morgen opduiken uit hun verborgen wereld. In de agar zit ook een antibioticum dat alle bacteriën die het nieuwe stukje DNA niet bezitten, doodt. Zo eindig je met een kweekplaatje met daarop je gemodificeerde bacterie. Klaar.
Of nog niet helemaal. Voor de onderzoekers begint het hier pas, want zij willen nu achterhalen of en in welke mate de nieuwe bacterie het gewenste antibioticum produceert. En dan moet je die interessante stoffen voor medicijnen ook nog isoleren. Hoe dan? Wel, ik zag tijdens mijn verblijf in het lab hoe Sofie Dekimpe en haar collega’s dat doen: jawel, door allerlei vloeistoffen bij elkaar te mengen zonder dat er eigenlijk iets te zien is. Als microbioloog moet je een bijna bovenmenselijke vaardigheid hebben om al die onzichtbare gebeurtenissen toch te zien gebeuren, lijkt me.

Crispr’en is soms een beetje zoals koken met een maaltijdbox. Elke box bevat de ingrediënten en recepten om uiteindelijk nieuwe DNA-sequenties te brouwen.
Het onzichtbare zichtbaar maken
Misschien vond ik dat wel het meest bijzondere aan mijn crispr-vuurdoop. Hoewel ik voortdurend bacteriën, plasmiden en stukjes DNA in mijn handen had, heb ik niets van dat ooit echt gezien. Ik moet aannemen dat er in de buisjes gebeurt wat er zou moeten gebeuren als ik het ene druppeltje met een pipet bij het andere druppeltje mik. Het blijft ontzettend abstract.
Uiteraard werken de onderzoekers ook niet compleet in het duister. Ze laten zich helpen door technieken om het onzichtbare zichtbaar te maken.
Zo zijn er nog visualisatietechnieken. Tussen het mengen door moet ik af en toe naar een kamer waar een spectrofotometer staat. Dat toestel meet de DNA-concentratie in een staal. Eigenlijk ziet het toestel net zoals de onderzoekers ook niets. Het leidt de DNA-concentratie af uit de hoeveelheid licht die het staal doorlaat. Ik mik met een pipet eerst een druppel water op de spectrofotometer, om een nulmeting te doen. Daarna plaats ik een druppel van het mengsel op het toestel. Uit het verschil in lichtdoorlaatbaarheid tussen het water en het mengsel leidt de spectrofotometer dan af hoeveel DNA er in het staal zit, en hoe zuiver het is.
Nog een andere visualisatiemethode, gelelektroforese, levert misschien nog het mooiste beeld op. Ik drop daarvoor een paar druppels van het mengsel in een bakje gevuld met een gel. ‘Het bakje heeft aan de ene zijde een positieve en aan de andere zijde een negatieve pool’, legt Dekimpe uit. ‘De DNA-moleculen bewegen zich in de richting van de positieve pool. Omdat de grotere moleculen trager bewegen dan de kleinere, ligt het DNA na een tijd uitgerokken tussen de negatieve en positieve pool. Na een uurtje kunnen we het patroon dan zien dankzij een kleurstof die zich aan de moleculen bindt en oplicht onder een uv-licht.’ Op dat moment kan je het DNA voor het eerst in het echt zien. ‘Altijd een magisch momentje’, voegt Dekimpe eraan toe. Alleen, ik zie helemaal niets. Net dit experiment heb ik met mijn amateurhanden waarschijnlijk verknoeid.
De meest precieze blik in je ‘onzichtbare brouwsel’ krijgen de onderzoekers dankzij sequencing. Vande Capelle: ‘Ik stuur daarvoor een staal op naar een extern bedrijf, en de volgende ochtend ontvang ik een mailtje met de volledige genetische code (het lange boek met A’s, T’s, G’s en C’s) en een reeks eigenschappen van mijn bacterie. Zo kom ik niet alleen te weten of de crispr is gelukt. Op basis van de genetische sequentie kan je ook min of meer voorspellen welke interessante stoffen de bacterie kan produceren.’
‘En nu is het aan jou!’ Terwijl alle info en indrukken van de voorbije dagen door mijn hoofd razen, neem ik afscheid van Hanne, Sofie, Joleen, Hans en ‘mijn’ genetisch gemodificeerde E. coli (mijn mentoren beloven dat ze me in de komende dagen nog wat opgroeifoto’s bezorgen). ‘Nu is het aan jou om het verhaal achter de genetische schaar te vertellen, zodat niemand nog hoeft te vragen: hoe gaat dat knippen en plakken eigenlijk in het echt?’ Net zoals microbiologen meester zijn in het zichtbaar maken van een onzichtbare wereld, hoop ik dan ook dat ik er intussen in ben geslaagd om jou, beste lezer, een inzicht te geven in het ‘onzichtbare’ begrip van de genetische schaar. Voor mij zal de analogie nooit meer hetzelfde klinken.



