Immuuntherapie is een revolutionaire behandeling tegen kanker. Helaas werkt de therapie niet bij alle kankerpatiënten. Onderzoeker Laurien Van Dyck onderzocht hoe we beter kunnen voorspellen wie er wel baat bij heeft én hoe we op termijn meer patiënten kunnen behandelen met deze therapie.
Beeld: Immuuncellen vallen een kankercel aan. Credit: Rita Elena Serda
Mobiele stukjes DNA maken een tumor aantrekkelijker voor het immuunsysteem, dat een een centrale rol speelt in de behandeling van kanker met immuuntherapie. Daarom onderzocht ik tijdens mijn doctoraat of en hoe we deze mobiele stukjes DNA kunnen gebruiken om de respons op immuuntherapie te voorspellen en verbeteren. Dat is heel relevant, gezien slechts twintig procent van de patiënten reageert op deze - nochtans revolutionaire - therapie. Voor de overige tachtig procent van de patiënten is de switch van ‘not’ naar ‘hot’ dus essentieel.
De immuuntherapie revolutie
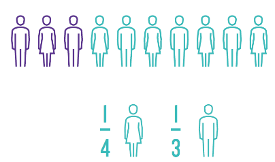
We kennen allemaal wel iemand die kanker heeft (gehad). Kanker is een wijdverspreide ziekte die in België ongeveer drie op tien mensen treft. Gelukkig herstellen steeds meer mensen van kanker, omdat we ondertussen meer weten over de ziekte en ze beter kunnen behandelen. Met traditionele behandelingen zoals chemotherapie of bestraling doden we de kwaadaardige tumorcellen, maar is er ook veel collateral damage door schade aan gezonde cellen. De ontwikkeling van immuuntherapie zorgde voor een nieuwe benadering: in plaats van de tumor rechtstreeks aan te vallen, helpen we het natuurlijke afweersysteem van ons lichaam, het immuunsysteem, om de tumor te doden. Hierdoor blijven de neveneffecten beperkt. Immuuntherapie is echter vooral revolutionair omdat het de levensduur en de levenskwaliteit van patiënten enorm kan verbeteren, soms zelfs bij uitgezaaide tumoren.
Immuun-checkpoint blockers zijn Nobelprijswaardig
In 2018 ging de Nobelprijs voor geneeskunde naar Allison en Honjo, onderzoekers die de basis legden voor de bekendste vorm van immuuntherapie: ‘immuun-checkpoint blockers’. De therapie blokkeert (‘blocks’) zogenaamde ‘immuun checkpoints’. Dit zijn eiwitten die lichaamseigen cellen van nature aanmaken om het immuunsysteem onder controle te houden. Via deze immuun checkpoints interageren ze met T-cellen (dit zijn immuuncellen) en schakelen ze zo uit. Tumorcellen hebben dit mechanisme gekaapt en maken er dankbaar gebruik van om te ontsnappen aan het immuunsysteem.
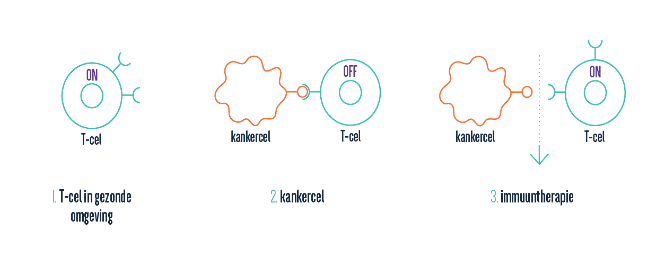
Via therapie kunnen we de immuun checkpoints blokkeren. Op die manier worden de T-cellen die uitgeschakeld waren door de tumor gereactiveerd. Deze veelbelovende therapie kan het immuunsysteem helpen om tumoren te verkleinen of volledig te verwijderen.
Kàn, want niet iedereen reageert op de therapie. Daarom heb ik in mijn doctoraat onderzocht of en hoe we kunnen voorspellen wie zal reageren op immuun-checkpoint blockers, en hoe we ook de andere patiënten kunnen helpen. De inzichten uit dit basisonderzoek op muizen en cellen legt interessante mechanismen voor de respons op immuuntherapie bloot, en vormt zo de basis voor verdere vertaling naar patiënten.
Revolutionair, maar niet voor iedereen
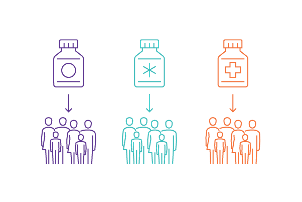
De resultaten van immuuntherapie zijn fantastisch, maar niet voor iedereen. Maar twintig procent van de patiënten reageert goed op de therapie, en deze respons is moeilijk te voorspellen. Voor het grootste deel van de patiënten gaat er dus hoop, tijd en geld verloren als de therapie niet aanslaat. Daarom gaat er veel onderzoek naar een manier om patiënten die op de therapie zullen reageren op tijd te identificeren. We zoeken biomerkers in het bloed of de tumor van de patiënt. Dit zijn stoffen die gerelateerd zijn aan een specifieke eigenschap van de tumor en ons zo vertellen welke patiënt geholpen zal zijn met de immuuntherapie. Daarnaast willen we begrijpen waarom de therapie soms niet aanslaat. Door hierop in te spelen, hopen we op termijn meer patiënten te laten reageren op immuuntherapie.
Aantrekkelijke tumoren
Voor een goede respons op immuuntherapie, speelt een actief immuunsysteem een essentiële rol. Immuuntherapie kan een van nature inactief immuunsysteem niet reactiveren. Dat is exact wat er gebeurt bij zogenaamde 'koude' tumoren. Ze slagen erin om onder de radar te blijven en het immuunsysteem in eerste instantie niet te activeren.
Andere tumoren worden wel herkend als lichaamsvreemd en trekken daardoor de aandacht van het immuunsysteem. We spreken dan van een warme of 'hot' tumor die aantrekkelijk is voor het immuunsysteem en het immuunsysteem activeert. Deze tumoren zullen wel reageren op immuuntherapie.
De grens tussen beide is dun, en tumoren kunnen switchen van 'hot' naar 'not' om te ontsnappen aan het immuunsysteem.
De switch van ‘not’ naar ‘hot’

Gelukkig kan die switch ook in de omgekeerde richting gemaakt worden, van ‘not’ naar ‘hot’. In ons onderzoek ontdekten we dat bepaalde mobiele stukjes DNA ervoor kunnen zorgen dat een tumor aantrekkelijker wordt voor het immuunsysteem. Deze stukjes DNA zijn in staat van de ene plaats in ons DNA naar een andere springen. Hoewel ze geen deel uitmaken van onze genetische code, kunnen ze veranderingen veroorzaken wanneer ze mobiel worden. En dit trekt de aandacht van ons immuunsysteem! Je kan het vergelijken met een spellingcorrector die een fout detecteert wanneer een woord uit een zin wegvalt of random ingevoegd wordt. Ook het vrijkomen van zo’n stukje mobiel DNA zal de aandacht trekken, zoals een losstaand woord dat niet tot een bepaalde zin behoort.
Tumoren waar zulke stukjes DNA verspringen, zijn dus meestal ‘hot’ en trekken de aandacht van het immuunsysteem. Ze kunnen reageren op immuuntherapie. We zagen dat koude tumoren er dan ook alles aan doen om die mobiele stukjes DNA uit te schakelen. Ze zetten er als het ware een rem op, om zich zo te blijven verbergen voor het immuunsystseem. Gelukkig ontrafelden we hoe de rem werkt en hoe we deze kunnen uitzetten. Door de mobiele stukjes DNA ook in koude tumoren aan te zetten, trachten we de interesse van het immuunsysteem op te wekken. We slaagden er zo in om in muizen koude tumoren te switchen naar warme tumoren, die vatbaarder kunnen zijn voor immuuntherapie.
Een dubbele functie, ook in het ziekenhuis?
Uit ons onderzoek blijkt dat mobiele stukjes DNA een dubbele functie zouden kunnen hebben voor de behandeling van patiënten. Enerzijds zijn ze een potentiele biomerker voor ‘hot’ tumoren, die aantrekkelijk zijn voor ons immuunsysteem en gevoelig aan immuuntherapie. Daarnaast zouden ze gebruikt kunnen worden om een tumor aantrekkelijker te maken voor het immuunsysteem en een oplossing bieden voor tumoren die initieel niet reageerden op immuuntherapie. Om deze resultaten uit muizen en cellen ook in patiënten te bevestigen, is meer onderzoek nodig. Gelukkig zijn onderzoekers hier volop mee bezig. Dankzij dit basisonderzoek worden zo de eerste stappen gezet om deze pistes verder te verkennen in het ziekenhuis.
‘Basisonderzoek is niet ‘basic’, maar legt de basis voor translationeel onderzoek en toepassingen voor patiënten. Ik ben trots dat ik hier met mijn doctoraat aan heb bijgedragen.’



