Katalin Karikó en Drew Weissman ontvangen de Nobelprijs voor Geneeskunde voor hun ontdekkingen die de ontwikkeling van effectieve mRNA-vaccins tegen covid-19 mogelijk maakten.
Beeld: Ill. Niklas Elmehed © Nobel Prize Outreach
De ontdekkingen van de twee Nobelprijswinnaars waren cruciaal voor de ontwikkeling van effectieve mRNA-vaccins tegen covid-19 tijdens de pandemie die begin 2020 begon. Door hun baanbrekende bevindingen, die ons begrip van de wisselwerking tussen mRNA en ons immuunsysteem fundamenteel hebben veranderd, hebben de laureaten bijgedragen aan de ongekende snelheid van vaccinontwikkeling tijdens een van de grootste bedreigingen voor de menselijke gezondheid in de moderne tijd.
Vaccins vóór de pandemie
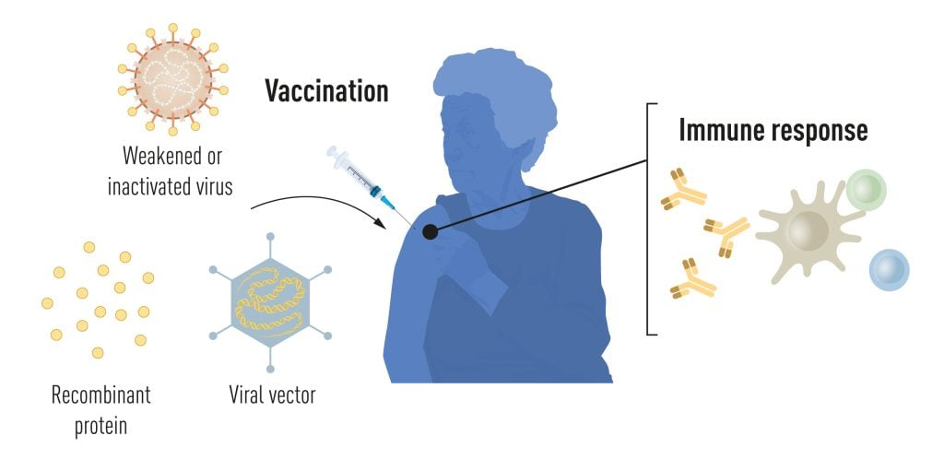
Vaccinatie stimuleert de vorming van een immuunrespons tegen een bepaalde ziekteverwekker. Dit geeft het lichaam een voorsprong in de strijd tegen de ziekte bij een latere blootstelling. Vaccins op basis van gedode of verzwakte virussen zijn al lang beschikbaar, zoals de vaccins tegen polio, mazelen en gele koorts. In 1951 kreeg Max Theiler de Nobelprijs voor Fysiologie of Geneeskunde voor de ontwikkeling van het vaccin tegen gele koorts.
Dankzij de vooruitgang in de moleculaire biologie in de afgelopen decennia zijn er vaccins ontwikkeld op basis van individuele virale componenten in plaats van hele virussen. Delen van de virale genetische code, meestal coderend voor eiwitten op het virusoppervlak, worden gebruikt om eiwitten te maken die de vorming van virusblokkerende antilichamen stimuleren. Voorbeelden hiervan zijn de vaccins tegen het hepatitis B-virus en het humaan papillomavirus. Als alternatief kunnen delen van de virale genetische code worden verplaatst naar een onschadelijk draagvirus, een ‘vector’. Deze methode wordt gebruikt in vaccins tegen het ebolavirus. Wanneer vectorvaccins worden geïnjecteerd, wordt het geselecteerde virale eiwit geproduceerd in onze cellen, waardoor een immuunrespons tegen het doelvirus wordt gestimuleerd.
Voor de productie van hele virus-, eiwit- en vectorgebaseerde vaccins is een grootschalige celkweek nodig. Dit arbeidsintensieve proces beperkt de mogelijkheden voor snelle vaccinproductie als reactie op uitbraken en pandemieën. Daarom hebben onderzoekers lang geprobeerd om vaccintechnologieën te ontwikkelen die onafhankelijk zijn van celkweek, maar dit bleek een uitdaging.
mRNA-vaccins: Een veelbelovend idee
In onze cellen wordt genetische informatie gecodeerd in DNA overgedragen naar boodschapper-RNA (mRNA), dat wordt gebruikt als sjabloon voor de productie van eiwitten. In de jaren 1980 werden efficiënte methoden geïntroduceerd om mRNA te produceren zonder celkweek, de zogenaamde in vitro-transcriptie. Deze beslissende stap versnelde de ontwikkeling van moleculair biologische toepassingen op verschillende gebieden. Ideeën om mRNA-technologieën te gebruiken voor vaccins en therapeutische doeleinden kwamen ook van de grond, maar er lagen problemen in het verschiet. In vitro getranscribeerd mRNA werd beschouwd als instabiel en moeilijk af te leveren, waardoor de ontwikkeling van gesofisticeerde lipidesystemen nodig was om het mRNA in te kapselen. Bovendien gaf in vitro geproduceerd mRNA aanleiding tot ontstekingsreacties. Het enthousiasme voor de ontwikkeling van de mRNA-technologie voor klinische doeleinden was daarom aanvankelijk beperkt.
Deze obstakels ontmoedigden de Hongaarse biochemicus Katalin Karikó niet. Ze legde zich toe op het ontwikkelen van methoden om mRNA te gebruiken voor therapie. In het begin van de jaren 1990, toen ze assistent-professor was aan de Universiteit van Pennsylvania, bleef ze trouw aan haar visie om mRNA als therapie te gebruiken, ondanks de moeilijkheden die ze ondervond om financiers van onderzoek te overtuigen van het belang van haar project. Een nieuwe collega van Karikó aan haar universiteit was de immunoloog Drew Weissman. Hij was geïnteresseerd in dendritische cellen, die belangrijke functies hebben bij immunosurveillance (een proces waarin het immuunsysteem een beschermende rol kan spelen) en de activering van vaccin-geïnduceerde immuunreacties. Aangespoord door nieuwe ideeën begon al snel een vruchtbare samenwerking tussen de twee, waarbij de focus lag op hoe verschillende RNA-types samenwerken met het immuunsysteem.
De doorbraak
Karikó en Weissman merkten dat dendritische cellen in vitro getranscribeerd mRNA herkennen als een vreemde stof, wat leidt tot hun activatie en het vrijkomen van ontstekingssignaalmoleculen. Ze vroegen zich af waarom in vitro getranscribeerd mRNA als vreemd werd herkend terwijl mRNA uit zoogdiercellen niet tot dezelfde reactie leidde. Karikó en Weissman realiseerden zich dat enkele kritieke eigenschappen de verschillende typen mRNA van elkaar moeten onderscheiden.
RNA bevat vier basen, afgekort A, U, G en C, die overeenkomen met A, T, G en C in DNA, de letters van de genetische code. Karikó en Weissman wisten dat de basen in RNA van zoogdiercellen vaak chemisch gemodificeerd zijn, terwijl in vitro getranscribeerd mRNA dat niet is. Ze vroegen zich af of de afwezigheid van gewijzigde basen in het in vitro getranscribeerde RNA de ongewenste ontstekingsreactie kon verklaren. Om dit te onderzoeken produceerden ze verschillende varianten van mRNA, elk met unieke chemische wijzigingen in hun basen, die ze toedienden aan dendritische cellen. De resultaten waren opvallend: de ontstekingsreactie werd bijna opgeheven als er basemodificaties in het mRNA werden aangebracht. Dit was een paradigmawisseling in ons begrip van hoe cellen verschillende vormen van mRNA herkennen en erop reageren. Karikó en Weissman begrepen meteen dat hun ontdekking van grote betekenis was voor het gebruik van mRNA als therapie. Deze baanbrekende resultaten werden gepubliceerd in 2005, vijftien jaar voor de covid-19 pandemie.
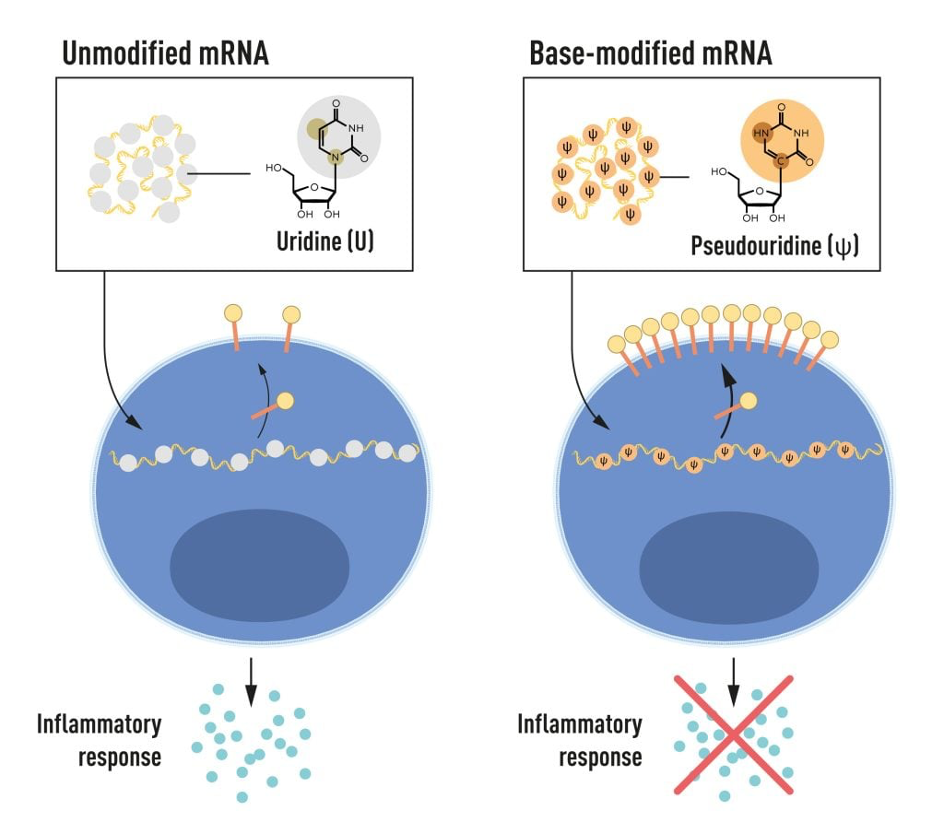
mRNA bevat vier verschillende basen, afgekort A, U, G en C. De Nobelprijswinnaars ontdekten dat mRNA met gewijzigde basen gebruikt kan worden om de activering van ontstekingsreacties te blokkeren (afscheiding van signaalmoleculen) en de eiwitproductie te verhogen wanneer mRNA aan cellen wordt toegediend. © Het Nobelcomité voor fysiologie of geneeskunde. Ill. Mattias Karlén
In andere onderzoeken, gepubliceerd in 2008 en 2010, toonden Karikó en Weissman aan dat de toediening van mRNA gegenereerd met base modificaties de eiwitproductie aanzienlijk verhoogde in vergelijking met ongemodificeerd mRNA. Het effect was te wijten aan de verminderde activering van een enzym dat de eiwitproductie reguleert. Door hun ontdekkingen dat basismodificaties zowel ontstekingsreacties verminderden en de eiwitproductie verhoogden, hadden Karikó en Weissman kritieke obstakels uit de weg geruimd op weg naar klinische toepassingen van mRNA.
mRNA-vaccins realiseren hun potentieel
De belangstelling voor de mRNA-technologie begon toe te nemen en in 2010 werkten verschillende bedrijven aan de ontwikkeling van de methode. Er werd gewerkt aan vaccins tegen het Zika-virus en MERS-CoV - die laatste is nauw verwant aan SARS-CoV-2. Na de uitbraak van de covid-19-pandemie werden in recordtempo twee basaal gemodificeerde mRNA-vaccins ontwikkeld die coderen voor het SARS-CoV-2 oppervlakte-eiwit. Er werden beschermende effecten van ongeveer 95% gerapporteerd en beide vaccins werden al in december 2020 goedgekeurd.
De indrukwekkende flexibiliteit en snelheid waarmee mRNA-vaccins kunnen worden ontwikkeld, maken de weg vrij om het nieuwe platform ook te gebruiken voor vaccins tegen andere infectieziekten. In de toekomst kan de technologie mogelijk ook worden gebruikt om therapeutische eiwitten af te leveren en bepaalde soorten kanker te behandelen.
Verschillende andere vaccins tegen SARS-CoV-2, gebaseerd op verschillende methodologieën, werden ook snel geïntroduceerd en samen zijn er wereldwijd meer dan 13 miljard doses van covid-19-vaccins gegeven. De vaccins hebben miljoenen levens gered en ernstige ziekten bij nog veel meer mensen voorkomen, waardoor samenlevingen konden terugkeren naar normale omstandigheden. Door hun fundamentele ontdekkingen van het belang van basemodificaties in mRNA hebben de Nobelprijswinnaars van dit jaar op kritische wijze bijgedragen aan deze transformatieve ontwikkeling tijdens een van de grootste gezondheidscrises van onze tijd.
Katalin Karikó werd geboren in 1955 in Szolnok, Hongarije. Ze promoveerde in 1982 aan de Universiteit van Szeged en deed tot 1985 postdoctoraal onderzoek aan de Hongaarse Academie van Wetenschappen in Szeged. Daarna deed ze postdoctoraal onderzoek aan de Temple University in Philadelphia en de University of Health Science in Bethesda. In 1989 werd ze benoemd tot assistent professor aan de Universiteit van Pennsylvania, waar ze bleef tot 2013. Daarna werd ze vicepresident en later senior vicepresident bij BioNTech RNA Pharmaceuticals. Sinds 2021 is ze professor aan de Universiteit van Szeged en adjunct professor aan de Perelman School of Medicine van de Universiteit van Pennsylvania.
Drew Weissman werd in 1959 geboren in Lexington, Massachusetts, VS. Hij behaalde zijn MD- en PhD-diploma aan de Universiteit van Boston in 1987. Hij volgde zijn klinische opleiding aan het Beth Israel Deaconess Medical Center aan de Harvard Medical School en deed postdoctoraal onderzoek aan de National Institutes of Health. In 1997 richtte Weissman zijn onderzoeksgroep op aan de Perelman School of Medicine van de Universiteit van Pennsylvania. Hij is professor in vaccinonderzoek en directeur van het Penn Institute for RNA Innovations.
Belangrijkste publicaties
Karikó, K., Buckstein, M., Ni, H. and Weissman, D. Suppression of RNA Recognition by Toll-like Receptors: The impact of nucleoside modification and the evolutionary origin of RNA. Immunity 23, 165–175 (2005).
Karikó, K., Muramatsu, H., Welsh, F.A., Ludwig, J., Kato, H., Akira, S. and Weissman, D. Incorporation of pseudouridine into mRNA yields superior nonimmunogenic vector with increased translational capacity and biological stability. Mol Ther 16, 1833–1840 (2008).
Anderson, B.R., Muramatsu, H., Nallagatla, S.R., Bevilacqua, P.C., Sansing, L.H., Weissman, D. and Karikó, K. Incorporation of pseudouridine into mRNA enhances translation by diminishing PKR activation. Nucleic Acids Res. 38, 5884–5892 (2010).



