Dé manier om het coronavirus op te sporen is met een PCR-test. Ook moordenaars lopen tegen de lamp via de techniek, die nog duizend en één andere toepassingen kent. Hoe werd PCR de gouden standaard voor zoveel onderzoek?
Ongeveer een jaar geleden, aan het begin van de coronapandemie, zat moleculair bioloog Marvin Tanenbaum in een Utrechts park te picknicken. Hij besprak met een vriendin hoe laboratoria sneller zouden kunnen testen op corona. Een stuk sneller, welteverstaan. Op dat moment kon een lab dagelijks een paar honderd tests uitvoeren. Een test vereiste veel handwerk en was daarmee verre van efficiënt. Het moest beslist mogelijk zijn om dagelijks duizenden of zelfs tienduizenden tests te doen. Toch?
Het was dan wel paaszondag, meteen na hun gesprek gingen de twee aan de slag. Ze zochten contact met robotexpert Martijn Bosch en die nacht nog hadden de drie een eerste versie van een plan klaar. Driekwart jaar later al prijkte een robot van hun ontwerp in een laboratorium in de Nederlandse provincie Brabant.
Het volledig automatische apparaat haalt testvloeistof uit minuscule buisjes die van verschillende locaties komen. Daaruit filtert de robot het RNA. Op basis van een PCR-test blijkt dan of daar genen tussen zitten van het coronavirus SARS-CoV-2. Een computer koppelt de uitslag automatisch aan de geteste persoon. Het resultaat: twintigduizend tests per dag in één laboratorium. Eindelijk konden onderzoekers op grote schaal beginnen testen.
Het was in alle opzichten een knap staaltje techniek. En toch is de echte ster van de show PCR, de polymerasekettingreactie. De moleculaire techniek is de meest betrouwbare om te zoeken naar de aanwezigheid van een virus. Toen het genetisch materiaal van het nieuwe coronavirus in januari vorig jaar in kaart was gebracht, was de PCR-test hiervoor in een mum van tijd klaar voor gebruik. Dat was niet mogelijk geweest zonder een paar toevallige vondsten in de jaren 1960 en ‘70.

Leven in kokend water
De eerste ontdekking valt toe te schrijven aan de Amerikaanse microbioloog Thomas Brock. Samen met een van zijn studenten trok hij er in 1966 op uit om leven te zoeken op een plek waar geen leven mogelijk kon zijn: de allerheetste warmwaterbronnen in Yellowstone National Park. Uit een paar buisjes water isoleerden zij eencelligen die zelfs in kokend water actief waren – een complete verrassing voor de wetenschap. Brock gaf zijn bacterie de naam Thermus aquaticus.
Tien jaar later volgde een nieuwe ontdekking, gedaan door twee biologiestudenten. Ze namen Brocks bacterie en isoleerden er een enzym uit dat ze Taq-polymerase noemden, waarbij Taq verwijst naar Thermus aquaticus. Een DNA-polymerase is een belangrijk werktuig voor cellen wanneer die zich vermenigvuldigen. Het enzym helpt namelijk om DNA te kopiëren voor nieuwe cellen. En deze polymerase bleek een unieke eigenschap te hebben. Anders dan vrijwel alle andere enzymen valt deze niet uit elkaar bij hoge temperaturen.
Dat was bijzonder. Maar het leidde nog niet direct tot een revolutie. Die kwam pas in de jaren 1980, toen biochemicus Karry Mullis de polymerasekettingreactie uitvond. Hij was de eerste die de Taq-polymerase gebruikte om DNA te vermeerderen. Het bleek een gouden zet. Om DNA te vermeerderen moet je de twee strengen waaruit DNA bestaat uit elkaar halen. Daarna kun je van elke streng een nieuwe dubbele streng maken. Die bevat dan dezelfde genetische informatie.
Vóór de komst van PCR waren onderzoekers drie weken bezig om een virus te detecteren, met moderne PCR kunnen ze dat in drie kwartier
DNA doet dat niet graag uit zichzelf. Het moet daartoe worden gedwongen door het te verhitten. Alleen: zulke hoge temperaturen vernietigen de enzymen die helpen om DNA te vermeerderen. Behalve Taqpolymerase, zag Mullis. Hij maakte het recept voor PCR met achtereenvolgens verhitten en afkoelen in telkens herhalende cycli. Elke cyclus levert twee keer zoveel DNA op. Na een aantal cycli is er dan genoeg DNA voor verder onderzoek. Mullis ontving voor zijn ontdekking in 1993 de Nobelprijs Chemie.
Eind jaren 1980 begonnen de eerste laboratoria in de Benelux met PCR te werken. Moleculair bioloog Maria Plug was een van de pioniers. Dolblij was ze toen ze als jonge onderzoeker aan de Universiteit Leiden PCR mocht uitproberen. ‘Al ging dat helemaal nog niet efficiënt. We hadden drie waterbaden met verschillende temperaturen en een gammele robotarm om een monster van het ene naar het andere bad over te brengen.’ Toch bood het een uitkomst.
Vóór de komst van PCR waren onderzoekers drie weken bezig om in een monster een virus te detecteren, met PCR konden ze dat in een dag. Een moderne PCR-machine heeft de klus al in drie kwartier geklaard.

Puzzel
Waarom willen onderzoekers zo nodig DNA vermeerderen? Omdat het bepaalde dingen aan het licht kan brengen. Als een monster een paar exemplaren van een virusgen bevat, kun je dat niet opsporen. Maar als het DNA van dat gen miljoenen kopieën heeft, dan wordt het wel zichtbaar. En dan kun je nagaan of een monster het virus in kwestie al dan niet bevat.
Aanvankelijk was het een hele puzzel om de juiste primer (het startstukje) samen te stellen om te vermeerderen. Tegenwoordig kunnen onderzoekers daarvoor grote genetische databases raadplegen. DNA-onderzoek is daardoor veel makkelijker geworden, weet Rob van Gijlswijk, een andere PCR-grootgebruiker. Hij doet onderzoek naar waterkwaliteit. ‘Nog niet zo lang geleden moesten we de biodiversiteit in een watermonster onderzoeken door diertjes te tellen. Nu nemen we een schepje water uit een sloot en analyseren we het DNA dat erin zit. Als ik wil zoeken op de aanwezigheid van rivierkreeftjes, dan kan ik de relevante genen in databases opzoeken.’
Bepaalde eiwitten voor medicijnonderzoek bestuderen, vaststellen of iemand een soa heeft, onderzoek met crispr en andere vormen van genmodificatie uitvoeren: het gebeurt allemaal het best met PCR
Volgens Maria Plug kun je in principe op alles wat leeft of heeft geleefd PCR toepassen. ‘Het DNA van een honderdduizend jaar oude slagtand of een lijk dat heel lang in de sloot heeft gelegen zal dan wel van een twijfelachtige kwaliteit zijn. Toch zit daar vaak nog wat bruikbaars in.’ Dat weten ze ook bij de recherche. Die gebruikt PCR voor verwantschapsonderzoek om de dader van een moord of zedenmisdrijf op te sporen.
Bepaalde eiwitten voor medicijnonderzoek bestuderen, vaststellen of iemand een soa heeft, onderzoek met crispr en andere vormen van genmodificatie uitvoeren: het gebeurt allemaal het best met PCR. In laboratoria voor moleculair onderzoek is PCR intussen even gewoon als het koffiezetapparaat in je keuken. Het DNA hoeft ook niet noodzakelijk van virussen te zijn. Ook het DNA van bacteriën, schimmels, planten en dieren afkomstig is te vermeerderen met PCR. Zelfs bij RNA-virussen, zoals SARS-CoV-2, kan het. RNA lijkt op DNA en kan eenvoudig worden omgezet, zodat PCR mogelijk is.
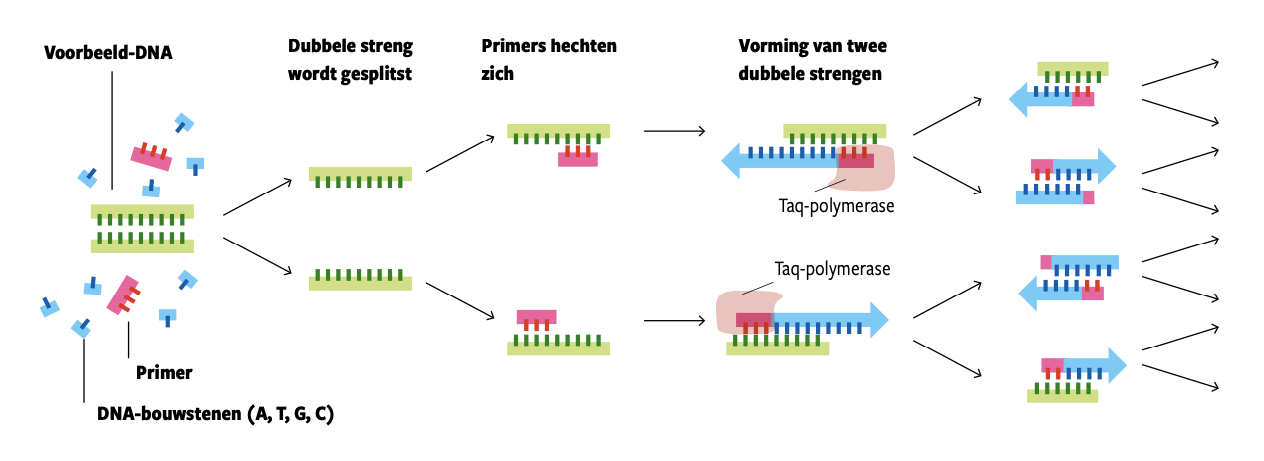
In het PCR- proces wordt elke dubbele DNA- streng gesplitst en opnieuw verdubbeld. Twee strengen worden er vier, vier worden er acht enzovoort. Tot er na een aantal cycli miljarden kopieën zijn.
Concurrentie
De komst van PCR in de jaren 1980 ontketende een ware genetische revolutie. De verbeteringen volgden elkaar snel op en voor elke nieuwe vorm was wel weer een toepassing. ‘Vandaag zijn er zelfs kleine PCR-apparaatjes die je aan een smartphone kunt koppelen’, weet Plug. ‘Die kun je meenemen naar een patiënt, in het veld of naar een plaats delict.’ Rob van Gijlswijk vult aan: ‘Bij grote bierbrouwerijen worden zulke apparaatjes gebruikt om te bepalen hoeveel gist er in de tank zit. Daar komt geen lab meer aan te pas.’
Ondanks alle mogelijkheden heeft de methode ook een beperking. Bij PCR vind je namelijk alleen wat je zoekt. Probeer je het coronavirus aan te tonen, dan zoek je naar genen van dat virus. Vind je die, dan is het simpel: het geteste individu draagt het virus in zich. Maar als je de virusgenen niet vindt, dan blijft het mogelijk dat het individu wel een ander virus draagt.
De PCR-test voor het coronavirus geeft ook geen antwoord op welke variant de patiënt heeft: de klassieke, de Britse, de Zuid-Amerikaanse, de Zuid-Afrikaanse of misschien nog een andere, onbekende variant. Bij al die varianten geeft de test gewoon een positieve uitslag.
Om zeker te weten met welke variant een patiënt besmet is, gebruikt een onderzoeker DNA-sequencing. In dat geval heeft hij geen specifiek stukje DNA om op te letten, zoals bij PCR. De onderzoeker weet namelijk niet van tevoren hoe het DNA in het monster eruitziet. Dus probeert hij de code – de volgorde van de letters A, T, G en C – te achterhalen van een onbekend stuk DNA.
In een bepaald opzicht zijn PCR en DNA-sequencing in de diagnostiek concurrenten van elkaar. Je kunt ze namelijk allebei gebruiken om een virus of bacterie aan te tonen. Ooit was DNA-sequencing veel omslachtiger en duurder dan PCR, maar dat verandert snel.
In de toekomst wordt het misschien net zo makkelijk om de lettervolgorde van DNA te achterhalen als om te zoeken naar een specifiek gen. In dat geval verliest de gouden PCR-standaard mogelijk zijn glans. Al denken Plug en Van Gijlswijk dat het nog jaren duurt voordat het zover is. Tot die tijd zullen mensenhanden en testrobots nog vele miljoenen PCR-tests doen om virussen op te sporen. En misschien blijft PCR voor moordzaken, medicijnontwikkeling, archeologische vondsten en crispr nog veel langer in zwang.