Het antwoord op de centrale vraag is een beetje vervelend. De meeste mensen begrijpen niks van water omdat in de lessen wetenschappen een achterhaald en ronduit foutief model voor vloeibaar water wordt aangeleerd. De wetenschap is dus zelf verantwoordelijk voor onze onkunde.
Misschien eerst het goede nieuws. De wetenschappelijke modellen voor een watermolecule, ijs en waterdamp zijn wel oké en een goed startpunt om vloeibaar water beter te begrijpen. We herhalen daarom even deze modellen voordat we vinger op de wonde leggen.
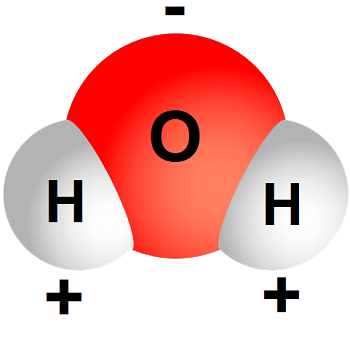
De watermolecule is de fundamentele bouwsteen van water. Hij bestaat uit twee kleine waterstofatomen gebonden aan een een 16 maal zwaarder zuurstofatoom. De molecule is elektrisch neutraal, maar het zwaartepunt van de negatieve en positieve ladingen valt niet samen. Hierdoor is water een polaire molecule, een cruciale eigenschap om het gedrag van watermoleculen te begrijpen. Het centrum van de negatieve ladingen ligt meer naar het zuurstofatoom toe waardoor de waterstofatomen deels positief geladen zijn (zie Fig. 1). De polariteit van de watermolecule is groot in vergelijking met andere moleculen. Dit verklaart waarom water, toch wel een heel lichte molecule, geen gas maar een vloeistof is bij kamertemperatuur.
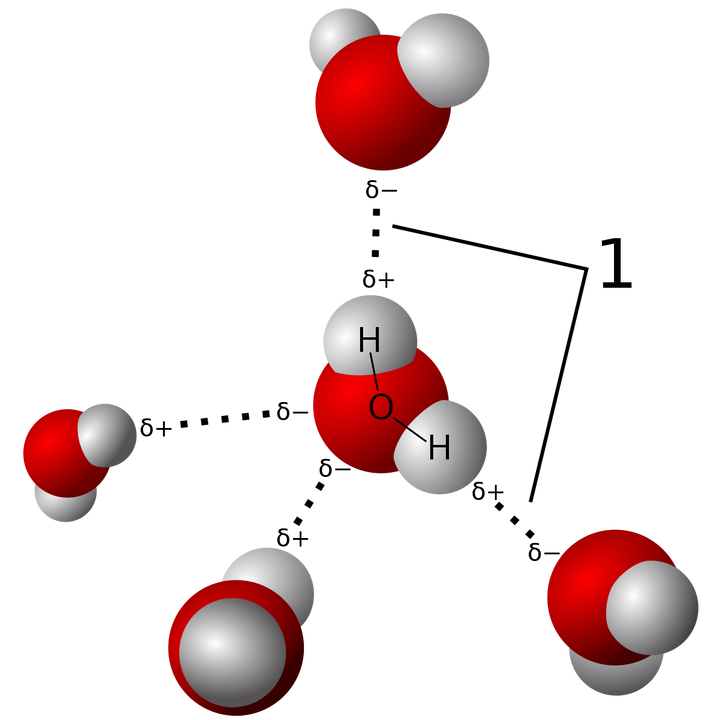
Wanneer de polaire watermoleculen dicht genoeg bij elkaar komen zullen ze zich binden aan elkaar. Het positieve deel van de waterstofatomen wordt aangetrokken door het het negatieve deel van de zuurstofatomen. Deze binding wordt een waterstofbrug genoemd en geeft een ruimtelijke oriëntatie aan de watermoleculen (Fig. 2). En hier loopt het al een beetje mis. In de meeste handboeken worden deze waterstofbruggen enkel vernoemd in de context van water, terwijl ze ook in ijs een belangrijke rol spelen en verantwoordelijk zijn voor de vaste ijsstructuur. Alleen waterdamp ontsnapt aan de invloed van de waterstofbruggen omdat de moleculen gemiddeld genomen te ver verwijderd zijn van elkaar.
De meest voorkomende vorm van ijs heeft een hexagonale kristalstructuur (zie Fig. 3 links). Elke watermolecule zit hierbij ruimtelijk vast in een kristalrooster en is verbonden met de vier dichtste buren. De relaties tussen de macroscopische eigenschappen van ijs en het microscopisch model zijn direct duidelijk. IJs is vast en moeilijk samendrukbaar net zoals zijn microscopische model.
Een model voor waterdamp (zie Fig. 3 rechts) is ook vrij voor de hand liggend. Waterdamp heeft een lage dichtheid en is gemakkelijk samendrukbaar. In ons microscopisch model hebben de watermoleculen een gemiddelde afstand die veel groter is dan in de vaste stof. Deze moleculen bewegen daardoor vrij en willekeurig door de ruimte. Er zijn geen stabiele waterstofbindingen mogelijk. Zowel de lage dichtheid en de samendrukbaarheid zijn consistent met onze voorstelling.
De vloeibare toestand is evenwel meer uitdagend. De dichtheid en de samendrukbaarheid van water hebben dezelfde grootte-orde als die van ijs. Dus de watermoleculen moeten net als in ijs dichtbij elkaar zitten. Maar hoe brengen we de vloeibaarheid van water in het model?

De meeste handboeken gaan deze vloeistofeigenschappen modelleren door aan te nemen dat dat de watermoleculen vrij en willekeurig bewegen 'zoals knikkers in een zak' (Fig. 4). Maar die zelfde molecules zaten toch ook dicht bij elkaar? Voel je de nattigheid?
De leerkrachten wetenschappen houden op dit moment hun mond over waterstofbruggen en hopen dat dit de slimmere studenten niet opvalt. Waarom spelen de waterstofbruggen hier geen rol? In water is deze vraag zelfs nog pijnlijker dan bij andere stoffen omdat de moleculen in water dichter bij elkaar zitten dan in ijs. Waarom is de polariteit van de watermoleculen, die sterk genoeg is om een vaste ijsstructuur te maken, plotseling onbelangrijk in die dichtere waterstructuur? Sommigen proberen het knikkermodel te redden door te stellen dat de moleculen in water meer thermische energie hebben en daardoor de waterstofbruggen zullen breken. Maar heel overtuigend is dit antwoord niet. De thermische energieverschillen zijn niet echt groot en bij 0°C komen zowel vloeibaar water als ijs voor en hebben hun moleculen dezelfde thermische energie.
We zitten nu in het hart van het waterprobleem. Onder het mom van didactische eenvoud hebben we iedereen (zelfs wetenschappers) opgesolferd met een gasachtig model voor vloeistoffen. We laten hen geloven dat de vloeistofmoleculen vrij bewegen om de vloeibaarheid te verklaren en verwaarlozen daarbij de fundamentele interacties tussen deze moleculen.
Er is overigens harde data die aantoont dat dit gasachtig model totaal bij het haar is getrokken. Men moet hiervoor gewoon de latente sublimatiewarmte van ijs op 0°C (51 kJ/mol) vergelijken met de smeltwarmte bij dezelfde temperatuur (6.0 kJ/mol). De sublimatiewarmte is de energie nodig om alle waterstofbruggen van de ijsstructuur te breken zodat we een gas bekomen zonder waterstofbruggen. De smeltwarmte is de energie nodig om de ijsstructuur te veranderen in een vloeibare structuur. De waarden liegen er niet om. Maar 12% van de bindingen wordt gebroken tijdens het smeltproces. Een vloeistof is geen zak met knikkers, de meeste watermoleculen zijn nog steeds gebonden. Vloeibaarheid gaat dus niet over volledig vrije molecules. Het gaat over een vaste structuur waarin een beperkt aantal moleculen vrij kunnen bewegen.

Vloeibaarheid is geen eigenschap van gassen maar een eigenschap van vaste stoffen. En dit is geen vreemd idee maar een wijd verspreid wetenschappelijk model. Zo gaat pek stromen als je lang genoeg wacht en worden ijsgletsjers vaste rivieren genoemd. Het concept vloeibaarheid wordt door Veritasium mooi uitgewerkt in 'Is glas vloeibaar?' We zijn gewoon aan het beeld dat vloeistoffen in enkele seconden een container vullen. Vaste stoffen zullen dat ook doen, maar dan op een andere tijdschaal. Het onderscheid tussen vloeistoffen en vaste stoffen hangt dus af van de menselijke tijd en is daardoor niet zo fundamenteel als we op het eerste zicht denken.
Deze bewustwording is een eerste stap weg van ons achterhaald gasachtig model voor water. Natuurlijk zijn er meer gebroken waterstofbruggen in water in vergelijking met ijs maar er zijn nog voldoende waterstofbruggen over om water een vaste structuur te geven. Water lijkt dus meer op ijs dan op waterdamp. Om ons watermodel te verbeteren moeten we dus volledig opnieuw naar water kijken maar nu met een andere bril op. Deze blog zal je helpen een fundamenteel nieuw en stevig watermodel op te bouwen.
De Engelse versie van deze blog vind je via deze link samen met de wetenschappelijke papers waarop dit nieuwe 'solide' model is gebaseerd.



